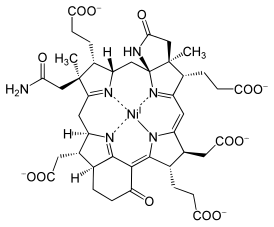
Кофактор F430
| Кофактор F430 | |
|---|---|
 | |
| Общие | |
| Хим. формула | C42H51N5NiO13– |
| Физические свойства | |
| Молярная масса | 906.58014 г/моль |
| Классификация | |
| Рег. номер CAS | 73145-13-8 |
| PubChem | 5460020 |
| SMILES | |
| InChI |
|
| ChEBI | 28265 |
| ChemSpider | 4573710 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
F430 — простетическая группа фермента метилкофермент-М-редуктазы. Был обнаружен в метаногенных Археях[1].
Этот фермент катализирует высвобождение метана на финальной стадии метаногенеза:
CH3-S-CoM + HS-CoB → CH4 + CoB-S-S-CoM
Корфин в контексте других тетрапирролов
[править | править код]Природа использует различные тетрапирролы — гемы, хлорофилл и кобаламин. F430 — самый восстановленный из природных тетрапирролов — в нём всего пять двойных связей. Это исключительное тетрапиррольное производное называется корфином. Из-за относительного недостатка сопряжённых связей, он жёлтый, а не ярко пурпурно-красный, что характерно для более ненасыщенных тетрапирролов. Это также единственное тетрапиррольное производное, содержащие никель. Ni(II) слишком мал для N4 связывающего сайта корфина, что заставляет макроцикл принимать более сморщенную форму.
Предполагаемый механизм метаногенеза
[править | править код]Активная форма F430 содержит Ni(I), аналогично восстановленному кофактору B12, содержащему Co(I). Принимая во внимание, что электроны Co(I) находятся в d8 и потому демагнитен, электроны Ni(I) находятся в состоянии d9 и парамагнитен. Механизм согласно которому природа разрывает CH3-S связь в метилкоферменте M до конца ещё неясен, хотя и известно, что кофермент B и кофермент M могут пройти в канал оканчивающийся осевым сайтом никеля. Правдоподобный механизм предполагает передачу электронов с Ni(I) (так он становится Ni(II)), и этот перенос электронов инициирует формирование CH4. В результате соединения радикала метил-КоМ с HS группой коэнзима высвобождается протон (H+) и захватывает один электрон, отнимает его у Ni(II) и восстанавливая Ni(I)[2].
Структура F430 была исследована при помощи рентгенокристаллографии и ядерно магнитно-резонансной спектрографии[3].
Бескислородное окисление метана
[править | править код]F430 в высоких концентрациях содержится в бактериях, которые по-видимому вовлечены в обратный метаногенез, вовремя которого метан превращается в метил-КоМ. В организмах которые осуществляют эту удивительную реакцию до 7 % и веса составляет никелевый протеин[4].
Источники
[править | править код]- ↑ Thauer R.K. Biochemistry of Methanogenesis: a Tribute to Marjory Stephenson (англ.) // Microbiology : journal. — 1998. — Vol. 144, no. 9. — P. 2377—2406. — doi:10.1099/00221287-144-9-2377. — PMID 9782487. Архивировано 17 мая 2020 года.
- ↑ Finazzo C., Harmer J., Bauer C., et al. Coenzyme B induced coordination of coenzyme M via its thiol group to Ni(I) of F430 in active methyl-coenzyme M reductase (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 2003. — April (vol. 125, no. 17). — P. 4988—4989. — doi:10.1021/ja0344314. — PMID 12708843.
- ↑ Farber G., Keller W.,Kratky C., Jaun B., Pfaltz A., Spinner C., Kobelt A., Eschenmoser A. Coenzyme F430 from Methanogenic Bacteria: Complete Assignment of Configuration Based on an X-ray Analysis of 12,13-diepi-F430 Pentamethyl Ester and n NMR Spectroscopy (англ.) // Helvetica Chimica Acta[англ.] : journal. — 1991. — Vol. 74. — P. 697—716.
- ↑ Kruger M., Meyerdierks A., Glockner F.O., et al. A conspicuous nickel protein in microbial mats that oxidize methane anaerobically (англ.) // Nature : journal. — 2003. — December (vol. 426, no. 6968). — P. 878—881. — doi:10.1038/nature02207. — PMID 14685246.